2018-03-19 14:58:12
Jessica J Lin, *Justin F Gainor
Center for Thoracic Cancers, Department of Medicine,
Massachusetts General Hospital Cancer Center, Boston,MA 02114, USA
翻译:小飞侠
免疫检查点抑制剂靶向程序性细胞死亡 -1(PD-1) - 程序化细胞死亡配体-1(PD-L1)轴已显著扩大非小细胞治疗选择,成为晚期NSCLC的治疗新选择。然而,大部分NSCLC患者对PD-1或PD-L1缺乏有效应答 - 这也正是学界致力于探索生物标记物的原因。 到现在,这种努力主要集中在评估PD-L1的表达,虽然其他几个生物标志物正在调查中。
对具有可靶向致癌驱动因子的肺癌患者,例如EGFR 突变( EGFR +)和间变性淋巴瘤激酶重排( ALK +),是正在被研究的领域。靶向治疗改变了这些病人的临床转归,但耐药不可避免。 早期的临床前研究2,3 提示EGFR- 驱动和 ALK 驱动的肿瘤可能具有疫原性的并因此对checkpoint抑制剂具有响应; 然而,最初的临床结果却未能证实这一点4,5。 一些前瞻性研究的汇总分析显示5,与化疗相比, EGFR + NSCLC 患者接受PD-1/L1治疗并未改善OS获益。因此,许多随机临床研究将携带有驱动基因的肺癌排除在外。
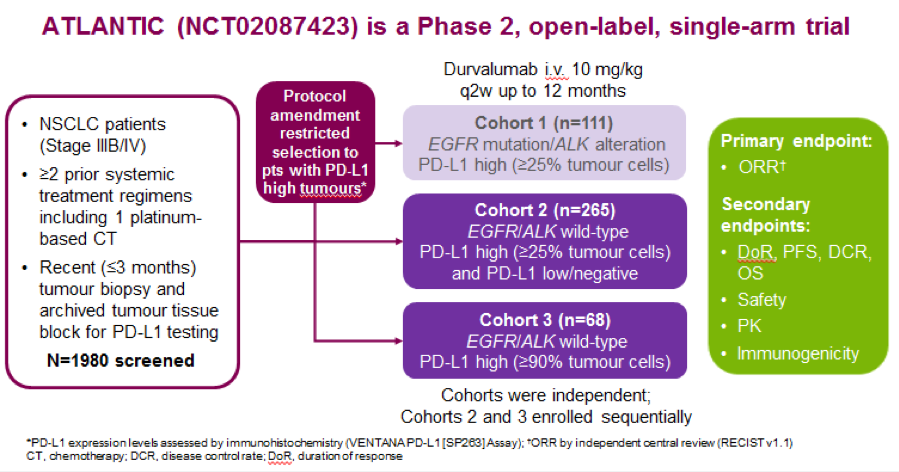
日前,Marina Garassino 及其同事在 The Lancet Oncology上发表了一项2期临床研究 ATLANTIC评估Durvalumab(PD-L1抑制剂)单药用于三线及以上NSCLC治疗的疗效。 接受多线治疗的NSCLC患者根据EGFR / ALK 状态和肿瘤细胞PD-L1表达被纳入三个队列:队列 1, EGFR + / ALK + NSCLC,至少25%肿瘤细胞表达PD-L1; 队列2, EGFR - / ALK -NSCLC中至少有25%的肿瘤细胞表达PD-L1; 和队列3, EGFR - / ALK - 非小细胞肺癌与至少90%的肿瘤细胞表达PD-L1 的。原来,无论PD-L1状态如何,患者均被纳入,但是随后的协议修订限制研究仅入组高PD-L1的患者( 即,任何染色强度下至少25%PD-L1呈阳性 的 细胞);因此,队列1和2也包括一些患者用表达PD-L1 的肿瘤细胞的小于25%。根据独立中央审查评估患者客观反应率:队列1 :9/74(12·2%; 95%CI 5·7 - 21·8),队列2:24/146(16·4%; 10·8 - 23·5),和在队列3: 21/68(30·9%; 20·2 - 43·3)。
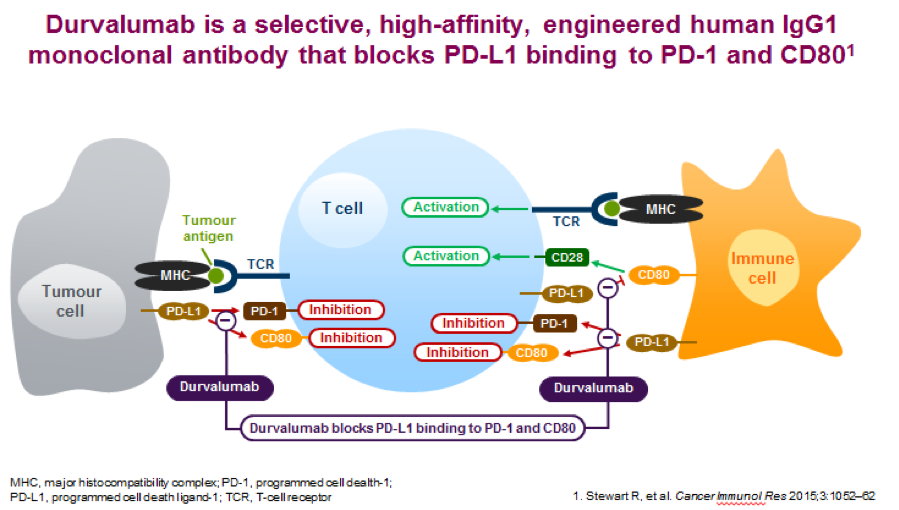
也许是ATLANTIC最显着的贡献是它代表了第一个前瞻性评估EGFR + / ALK + NSCLC 患者使用免疫检查点抑制剂的疗效。与早先的报告一致的是, EGFR + / ALK + NSCLC患者具有低PD-L1表达很少对durvalumab的应答率很低(只有一个[4%]这些队列1中的28名患者实现了客观反应)。然而,EGFR + / ALK + NSCLC且至少有25%的肿瘤细胞表达PD-L1细胞患者客观反应报道12.2%(9/74例,95%CI 5 · 7 - 21 · 8)。这种中低度应答显示免疫检查点抑制可能仍然是某些基因驱动的非小细胞肺癌的可行选择。
但是,这个队列可能并不完全对典型的患者EGFR + / ALK +非小细胞肺癌具有代表性。例如,大多数患有EGFR + / ALK + NSCLC的患者(315/425 [74%])在ATLANTIC中筛查出PD-L1低表达(<25% 表达PD-L1的肿瘤细胞),而只有14.6 %(425人中的62人)至少有90%的表达PD-L1的肿瘤细胞。然而,47例/111(42%)EGFR + / ALK + NSCLC且至少有90%的表达PD-L1的肿瘤细胞患者在队列1中实际接受治疗。而且,在EGFR + NSCLC的10位有肿瘤应答者中 ,6位是现/曾吸烟者,8位具有超高PD-L1表达(90 - 100% 的肿瘤细胞的表达 PD-L1)。
尽管这项研究将 EGFR +和 ALK + NSCLC患者分组在一起,但研究可能表明这两类驱动基因具有不同的免疫原性 - 例如尽管 ALK + 患者NSCLC具有PD-L1过表达频率比 EGFR +非小细胞肺癌患者更高 ,但其仅集中在 EGFR +组中看到durvalumab抗肿瘤活性,虽然 ALK + 患者接受PD-1检测的数量很小。这一发现强调 PD-L1表达不能作为单一因素可能需要辅之以其他因素,如临床特征( 如 吸烟),免疫细胞密度和肿瘤突变负荷。
因为大多数EGFR + /ALK + NSCLC患者对PD-1或PD-L1抑制剂无肿瘤应答,开发新的基于免疫的组合仍然是一个至关重要的需求。在IMpower150中,8与化疗相比较atezolizumab 联合卡铂和紫杉醇和贝伐单抗导致显著改善EGFR + / ALK + NSCLC 患者的无进展生存率,这从一个潜在的有临床获益的组合方式。免疫联合试验必须并辅之以针对性的转化研究更好地定义和调整EGFR + / ALK + 肿瘤免疫医疗疗格局。在一项研究中,接受EGFR的EGFR + NSCLC患者抑制剂osimertinib治疗的患者配对活检标本提示治疗后PD-L1表达减少CD8 + T细胞表达增加,这一变化与炎症反应相似。然后osimertinib加上免疫检查点抑制剂的联合观察到较高的肺毒性,这凸显了这种组合策略面临的挑战。突出了与小说发展相关的挑战免疫疗法和靶向治疗组合。
总的来说,ATLANTIC免疫检查点抑制剂在EGFR +中的活性和ALK + NSCLC的应用提供了宝贵的见解。
虽然免疫检查点抑制剂单药治疗可能最终在高度选择驱动基因阳性患者中起作用,但是仍需要进一步研究进行探索。现在,临床医生应该考虑指导EGFR +/ALK + NSCLC患者进入免疫治疗组合的临床试验。这样的努力可能为免疫基础创造潜在的空间 - 迄今为止一个很大程度上未知的领域。
Lancet Oncol 2018 Published Online March 12, 2018
7 评论
评论列表test12
好文
2018-06-10 18:39:33

testxx
\x22\x3c
2018-06-08 19:32:04

testxx
<img>
2018-06-08 19:30:44
技术支持
是吗
2018-04-18 12:05:11
技术支持
好
2018-03-29 17:45:41